Degeneração macular terá tratamento excepcional
Medicamento bevacizumabe poderá ser utilizado nos programas do Ministério da Saúde para tratamento da degeneração macular, doença que compromete a visão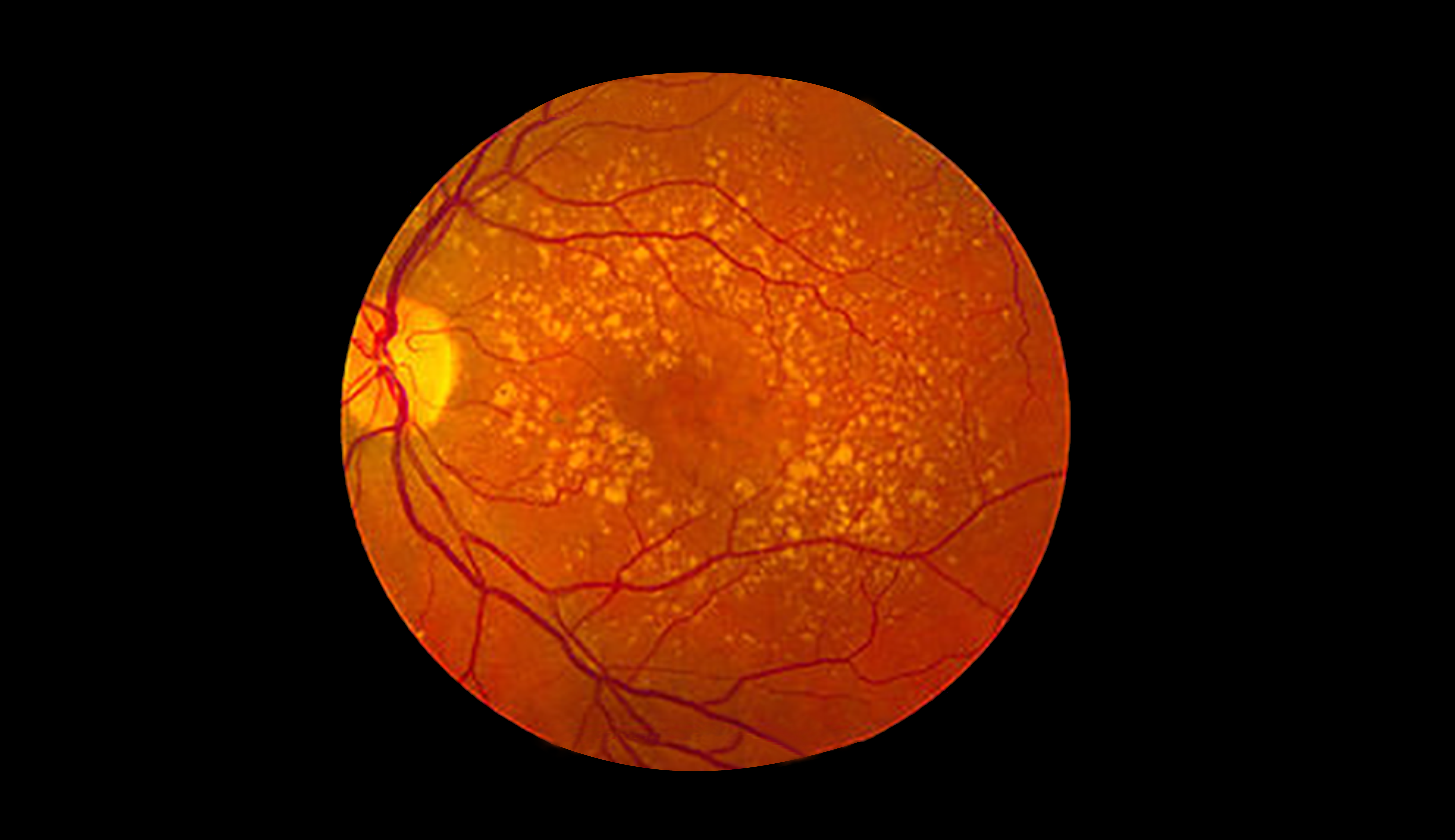
Uma nova opção de tratamento para pessoas que desenvolveram Degeneração Macular Relacionada à Idade (DMRI), condição que compromete a visão, poderá ser incorporada ao Sistema Único de Saúde (SUS). A Anvisa aprovou a regulamentação que autoriza o uso excepcional do bevacizumabe (Avastin®) para o tratamento dessa doença no SUS. A decisão foi tomada na Reunião Ordinária Pública (ROP) do último dia 30 de agosto e resultou na Resolução da Diretoria Colegiada (RDC) 111/2016, publicada no Diário Oficial da União (DOU) na edição do dia 8 de setembro.
O Avastin® (bevacizumabe) tem registro na Anvisa desde 2002, mas como medicamento oncológico para o tratamento do carcinoma metastásico. Não há registro desse medicamento para uso oftalmológico na Anvisa ou em outra agência internacional.¿Ao longo dos anos, no entanto, pesquisas comprovaram que o bevacizumabe é efetivo no tratamento da DMRI, doença que acomete a população a partir dos 50 anos, sendo mais frequente a partir dos 65 anos.
Atualmente, o medicamento é empregado para tratar a DMRI em muitos países, como Itália, França, EUA, Tailândia e também no Brasil. É o uso “off label”, ou seja, fora das indicações previstas em bula.
A decisão da Anvisa atende a uma solicitação de autorização de uso feita pela Comissão Nacional de Incorporação de Tecnologias no SUS (Conitec), do Ministério da Saúde, feita com base nos estudos científicos sobre o efeito do bevacizumabe na DMRI.
A solicitação enviada à Anvisa pelo Ministério da Saúde está prevista no Artigo 21 do Decreto 8.077, de 14 de agosto de 2013:
“Art. 21. Mediante solicitação da Comissão Nacional de Incorporação de Tecnologias no SUS - Conitec, a Anvisa poderá emitir autorização de uso para fornecimento, pelo SUS, de medicamentos ou de produtos registrados nos casos em que a indicação de uso pretendida seja distinta daquela aprovada no registro, desde que demonstradas pela Conitec as evidências científicas sobre a eficácia, acurácia, a efetividade e a segurança do medicamento ou do produto para o uso pretendido na solicitação. ”
A autorização dada pela Anvisa tem duração de três anos, renovável por igual período. Na RDC 111/2016, a Agência estabeleceu as exigências sanitárias às quais está condicionado o uso do medicamento.